Différences entre versions de « Biofilm et Plaies chroniques »
Sauter à la navigation
Sauter à la recherche
| (50 versions intermédiaires par 3 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
| − | Les plaies chroniques sont très souvent colonisées par un Biofilm | + | Les [[Plaie chronique|plaies chroniques]] sont très souvent colonisées par un Biofilm |
| − | sont des communautés bactériennes qui colonisent les plaies chroniques et impactent le processus de cicatrisation | + | sont des communautés bactériennes qui colonisent les [[Plaie chronique|plaies chroniques]] et impactent le processus de cicatrisation |
==Généralités == | ==Généralités == | ||
| − | === | + | ===Définition=== |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | * A la surface d'une plaie, les micro-organismes existent dans une forme libre, flottant dans le milieu : on parle de '''bactéries planctoniques'''. Mais il existe un autre mode de vie bactérienne : les '''biofilms''' | |
| − | * Un biofilm est une communauté structurée de bactéries, enrobée d'une matrice polymérique et attachée | + | * Un biofilm est une communauté structurée de bactéries, enrobée d'une matrice polymérique et attachée à une surface |
| − | * Le biofilm protège les bactéries et leur permet de vivre | + | * Le biofilm protège les bactéries et leur permet de vivre dans un environnement hostile en résistant aux traitements antibiotiques, antiseptiques et à la réponse immunitaire de l'hôte |
===Formation d'un biofilm sur une plaie=== | ===Formation d'un biofilm sur une plaie=== | ||
| Ligne 22 : | Ligne 18 : | ||
[[Fichier:Biofilm.png|vignette|Formation d'un biofilm]] | [[Fichier:Biofilm.png|vignette|Formation d'un biofilm]] | ||
| − | + | * Un biofilm peut se mettre en place très rapidement, en 24 à 36 heures | |
| − | * | ||
| − | + | ::- les bactéries planctoniques adhèrent à une surface : tissu dévitalisé ([[nécrose]] / fibrine / hématome), sur un corps étranger (os / [[tendon]] / calcification / [[matériel prothétique]]), ou sur le tissu de granulation | |
| − | + | ::- en quelques heures cette adhésion devient irréversible et les colonies bactériennes sécrètent une matrice polymérique, composée à 97 % d'eau, dans laquelle elles seront protégées | |
| − | + | ::- la dernière étape est celle de la dispersion. Le biofilm se fragmente, libérant des bactéries qui vont pouvoir aller se fixer à distance et fabriquer un nouveau biofilm | |
| + | |||
| + | ===Résistance des biofilms=== | ||
| − | + | * Les biofilms ont la capacité à survivre dans un environnement hostile, et les bactéries d'un biofilm sont moins sensibles aux antibiotiques, aux antiseptiques et à la réponse immunitaire | |
| − | * | + | * On parle d'un phénomène de '''Tolérance''' des biofilms qui est dû à l'effet barrière de la matrice, à une modification de la composition chimique de la matrice, à des modifications génétiques des bactéries et, enfin, à la présence de cellules persistantes (bactéries "dormantes" qui résistent à de très hautes concentrations d'antibiotiques et qui expliqueraient le caractère récidivant des infections) |
| − | + | ==Les [[Plaie chronique|plaies chroniques]] sont-elles colonisées par un biofilm ? <ref>www.wounds-uk.com/resources/details/position-document-management-biofilm</ref>== | |
| − | + | * Le micro-environnement des [[Plaie chronique|plaies chroniques]] avec des débris nécrotiques, des exsudats, une diminution de la pression d'oxygène et une diminution de la réponse immune de l'hôte sont des conditions favorables pour la croissance bactérienne | |
| − | * | + | * La prévalence exacte d'un biofilm sur les [[Plaie chronique|plaies chroniques]] reste cependant incertaine en raison des critères d'inclusion et des modalités de prélèvement |
| + | * L'étude initiale de James en 2008 retrouvait la présence de biofilm dans 60 % des plaies chroniques analysées contre 6 % seulement dans les cas de plaies aiguës <ref>James GA, Swogger E, Wolcott R, Pulcini Ed, Secor P, Sestrich J, Costerton JW, Stewart PS. Biofilms in chronic wounds. Wound Repair Regen. 2008;16:37-44.</ref> | ||
| + | * D'autres études évoquent la présence quasi systématique de biofilm sur les plaies chroniques <ref>Wolcott RD, Rhoads DD, Bennett ME, Wolcott BM, Gogokhia L, Costerton JW, Dowd SE. Chronic wounds and the medical biofilm paradigm. J Wound Care. 2010;19(2):45-6, 48-50, 52-3.</ref> <ref>Metcalf DG, Bowler PG. Clinician perceptions of wound biofilm. Int Wound J. 2014;8. doi: 10.1111/iwj.12358.</ref> <ref>Malone M, Bjarnsholt T, McBain AJ et al. The prevalence of biofilms in chronic wounds: a systematic review and meta-analysis of published data. Journal of Wound Care 2017 26(1):20–5</ref> | ||
| − | == | + | ==Quel est l'impact du biofilm sur les [[Plaie chronique|plaies chroniques]] ?== |
| − | + | ====Inflammation chronique==== | |
| − | * | + | * Le biofilm entretient l’inflammation chronique avec la persistance de cellules inflammatoires (polynucléaires neutrophiles, macrophages...), de cytokines inflammatoires et de protéases |
| − | + | * L'inflammation est également liée à des [[Facteurs de risque infectieux liés à l'hôte|facteurs liés à l'hôte]]: hypoxie, immunodépression,[[dénutrition]] | |
| − | + | ====Retard de cicatrisation==== | |
| − | * | + | * L'inflammation provoque la destruction de la matrice extra-cellulaire, la diminution des facteurs de croissance |
| − | ==== | + | ====Risque d'infection et d'infections récidivantes==== |
| − | + | ==Comment faire le diagnostic du biofilm sur une plaie ?== | |
| − | + | [[Fichier:Biofilm1.png|vignette|Biofilm / Slime]] | |
| − | + | [[Fichier:Déterction du biofilm.png|vignette|Algorithme diagnostic du biofilm]] | |
| − | + | ===Diagnostic clinique=== | |
| − | ==== | + | =====Contexte ===== |
| − | * | + | * En l'absence de critère diagnostique précis, on évoquera la présence de biofilm : |
| − | + | ::- devant des plaies qui n'évoluent pas favorablement malgré des soins bien conduits et une prise en charge globale de l'étiologie et des facteurs de retard de cicatrisation | |
| − | + | ::- devant des épisodes infectieux récidivants | |
| + | =====Aspect clinique du biofilm===== | ||
| − | + | * Le diagnostic clinique reste compliqué | |
| − | + | * On évoque la notion de '''slime''' (photo). Le biofilm ressemble à un gel brillant qui recouvre la surface de la plaie. Néanmoins, il est parfois difficile de différencier slime et fibrine | |
| − | * | + | * La couleur verte, bien connue et attribuée à la présence ''[[Pseudomonas aeruginosa et plaies chroniques|Pseudomonas aeruginosa]]'', peut évoquer la présence d'un biofilm liée à cette bactérie |
| − | + | =====Algorithme diagnostic===== | |
| − | * | + | * Un algorithme (schéma à droite) a été proposé selon une démarche clinique simple <ref>Percival SL, Vuotto C, Donelli G, Lipsky BA, Biofilms ans wounds : an identification algorithm and potential treatment options. Advances in Wound Care 2015 ;4(7):389-97</ref> |
| − | + | ===Diagnostic microbiologique=== | |
| − | * | + | * Il n'y a a pas d'"examen de routine" capable de diagnostiquer un biofilm sur une plaie ni de marqueur biologique attestant leur présence. |
| − | + | * Les examens spécialisés (microscopie électronique , techniques moléculaires) peuvent parfois avoir des difficultés à différentier les bactéries planctoniques de celles incluses dans un biofilm | |
| + | ==Prise en charge du biofilm sur une [[plaie chronique]]== | ||
| − | + | * Un biofilm doit être pris en charge de façon rapide et "agressive" pour être efficace rapidement et limiter le risque de chronicité | |
| − | + | * Quatre axes de prise en charge devant un biofilm | |
| − | + | {| class="wikitable" | |
| − | + | |- | |
| − | + | ! Provoquer la dispersion du biofilm !! !! Éviter la colonisation !!!! Éviter la phase d'attachement irréversible !!!! Éliminer les bactéries sessiles | |
| − | + | |} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ===Hygiène de la plaie=== | |
| − | + | * Une hygiène rigoureuse lors des soins reste un élément indispensable pour éviter la contamination des plaies. Pour autant les soins de plaies ne doivent pas être réalisés en "ambiance stérile" | |
| − | * | + | * Le lavage à l'eau et au savon reste un élément indispensable, même s'il ne s'agit pas, à proprement parler, d'un acte de [[Détersion]] <ref>Bellingeri A et al. Effect of a wound cleansing solution on wound bed preparation and inflammation in chronic Wounds: a single-blind RCT. J Wound Care 2016; 25: 3, 160–168.</ref> |
| + | * On peut s'aider de solution de '''surfactant'''. Ces produits tensio-actifs réduisent la tension superficielle entre un liquide et un solide et aident à l'élimination des tissus dévitalisés, des corps étrangers et des bactéries planctoniques. Nous disposons, par exemple, du Prontonsan composé de PHMB (polyhexaméthylène biguanide) et de bétaïne | ||
| + | ===[[Détersion]]=== | ||
| + | * la [[Détersion]] de la plaie reste la pierre angulaire du traitement du biofilm | ||
| + | * Elle permet : | ||
| + | ::- de détacher les bactéries sessiles de la surface d'adhérence | ||
| − | + | ::- de provoquer la dispersion du biofilm | |
| − | + | ::- de supprimer les surfaces d'adhérence du biofilm : tissus dévitalisés ([[nécrose]], fibrine, hématome) et corps étrangers (os, [[tendon]], calcification, [[matériel prothétique]], débris de pansements) | |
| − | * | + | * Aucun moyen de [[Détersion]] ne peut être privilégié par rapport à un autre pour l'élimination du biofilm. Le mode de [[Détersion]] doit être évalué en fonction : |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ::- de l'étiologie et d'éventuelles contre-indications à une [[détersion mécanique]] | |
| − | + | ::- à la [[douleur]] induite | |
| − | + | ::- à la présence de corps étrangers qui peuvent justifier une [[détersion chirurgicale]] (os/ [[tendon]] / prothèse) | |
| − | + | ::- à l'état de la [[Peau Péri Lésionnelle|peau péri-lésionnelle]]: une [[détersion en milieu humide]] sera évitée en cas de [[macération]] de la peau périphérique | |
| − | + | ::- des disponibilités en matériel et des compétences du soignant | |
| − | * | + | * [[Détersion mécanique|Détersion mécanique]] |
| − | + | ::- Cette technique de [[Détersion]] utilisant la curette peut être réalisée sous réserve de l'absence de contre-indication | |
| − | ::- | + | ::- On peut s'aider de solution de surfactant |
| − | + | *[[Détersion chirurgicale]] | |
| − | + | ::- Elle doit être envisagée rapidement devant des [[nécrose]]s étendues, des plaies complexes avec exposition osseuse ou tendineuse | |
| − | * | + | * Autres moyens de [[Détersion]] anti biofilm : |
| − | + | ::- Irrigation sous pression | |
| − | + | ::- [[Thérapie à Pression Négative (TPN)|TPN]] (Thérapie à Pression Négative) | |
| − | + | ::- [[Electrostimulation|Électrostimulation]] | |
| − | + | ::- [[Larvothérapie]] | |
| − | ::- | + | ::- Ultra-sons |
| − | + | ===Agents anti-biofilm=== | |
| − | + | * L'utilisation de ces produits s'impose après la phase de [[Détersion]] afin d'éviter la reformation du biofilm | |
| − | + | * Les antiseptiques et antibiotiques locaux classiquement utilisés sont peu utiles et ne doivent pas être utilisés | |
| − | + | * Les nouveaux agents anti-biofilm inter-agissent avec la matrice ou les composants du biofilm | |
| − | + | ::- [[Prontosan ®|Prontosan]] qui associe un antibactérien, le polyhexanide (1%), et un surfactant, la bétaïne (0.1%). Il est disponible sous forme de gel à utiliser directement sur les plaies ou de solution de lavage | |
| − | + | ::- Lavasept qui associe le polyhexanide et un surfactant, le macrogol | |
| − | + | ::- Octenilline qui associe un antisptique, l'octenidine chloride et un [[hydrogel]] | |
| − | + | ::- EDTA (acide ethylène diamine tetra-acétique) : ce produit assure le détachement des bactéries et augmente la perméabilité cellulaire. Il existe dans le pansement Aquacel Ag Extra®, en association avec de l'argent et du chlorure de benzethhium (BeCl) | |
| − | + | * Pansement anti-biofilms | |
| − | + | ::- Pansements de la [[détersion en milieu humide]] en cas de [[nécrose]] et fibrine sèche : [[hydrogel]] / [[Irrigo absorbants|irrigo-absorbant]] | |
| − | + | ::- Pansements absorbants qui limitent les exsudats en cas de [[plaie exsudative]] | |
| − | + | ::- Pansements contenant un antiseptique : pansement à l'argent, pansements au PHMB | |
| − | + | ::- Pansement avec DACC (chlorure de dialkyl carbamoyle ): la gamme Sorbact® propose un pansement qui agit par un mécanisme d'hydrophobie en fixant les bactéries et le biofilm à sa surface | |
| − | === | + | ===En pratique...=== |
| − | * | + | * Envisager la présence de biofilm sur toutes les [[Plaie chronique|plaies chroniques]] en retard de cicatrisation |
| − | * | + | * Assurer une [[Détersion]] quotidienne efficace, par une [[détersion mécanique]] ou par des techniques plus spécifiques et spécialisées si besoin (chirurgie , [[Thérapie à Pression Négative (TPN)|TPN]], [[Electrostimulation|électrostimulation]]) |
| − | * | + | * Utiliser des pansements absorbants qui vont absorber les exsudats et piéger les bactéries |
| − | * | + | * Intérêt des pansements spécifiques comme Sorbact® |
| − | + | * L'utilisation des produits anti-biofilm est difficile en raison de l'absence de remboursement | |
==Références== | ==Références== | ||
Version actuelle datée du 9 septembre 2020 à 11:43
Les plaies chroniques sont très souvent colonisées par un Biofilm
sont des communautés bactériennes qui colonisent les plaies chroniques et impactent le processus de cicatrisation
Généralités
Définition
- A la surface d'une plaie, les micro-organismes existent dans une forme libre, flottant dans le milieu : on parle de bactéries planctoniques. Mais il existe un autre mode de vie bactérienne : les biofilms
- Un biofilm est une communauté structurée de bactéries, enrobée d'une matrice polymérique et attachée à une surface
- Le biofilm protège les bactéries et leur permet de vivre dans un environnement hostile en résistant aux traitements antibiotiques, antiseptiques et à la réponse immunitaire de l'hôte
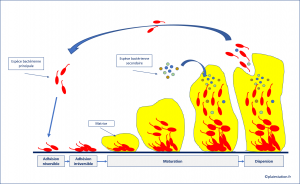
Formation d'un biofilm sur une plaie
- Un biofilm peut se mettre en place très rapidement, en 24 à 36 heures
- - les bactéries planctoniques adhèrent à une surface : tissu dévitalisé (nécrose / fibrine / hématome), sur un corps étranger (os / tendon / calcification / matériel prothétique), ou sur le tissu de granulation
- - en quelques heures cette adhésion devient irréversible et les colonies bactériennes sécrètent une matrice polymérique, composée à 97 % d'eau, dans laquelle elles seront protégées
- - la dernière étape est celle de la dispersion. Le biofilm se fragmente, libérant des bactéries qui vont pouvoir aller se fixer à distance et fabriquer un nouveau biofilm
Résistance des biofilms
- Les biofilms ont la capacité à survivre dans un environnement hostile, et les bactéries d'un biofilm sont moins sensibles aux antibiotiques, aux antiseptiques et à la réponse immunitaire
- On parle d'un phénomène de Tolérance des biofilms qui est dû à l'effet barrière de la matrice, à une modification de la composition chimique de la matrice, à des modifications génétiques des bactéries et, enfin, à la présence de cellules persistantes (bactéries "dormantes" qui résistent à de très hautes concentrations d'antibiotiques et qui expliqueraient le caractère récidivant des infections)
Les plaies chroniques sont-elles colonisées par un biofilm ? [1]
- Le micro-environnement des plaies chroniques avec des débris nécrotiques, des exsudats, une diminution de la pression d'oxygène et une diminution de la réponse immune de l'hôte sont des conditions favorables pour la croissance bactérienne
- La prévalence exacte d'un biofilm sur les plaies chroniques reste cependant incertaine en raison des critères d'inclusion et des modalités de prélèvement
- L'étude initiale de James en 2008 retrouvait la présence de biofilm dans 60 % des plaies chroniques analysées contre 6 % seulement dans les cas de plaies aiguës [2]
- D'autres études évoquent la présence quasi systématique de biofilm sur les plaies chroniques [3] [4] [5]
Quel est l'impact du biofilm sur les plaies chroniques ?
Inflammation chronique
- Le biofilm entretient l’inflammation chronique avec la persistance de cellules inflammatoires (polynucléaires neutrophiles, macrophages...), de cytokines inflammatoires et de protéases
- L'inflammation est également liée à des facteurs liés à l'hôte: hypoxie, immunodépression,dénutrition
Retard de cicatrisation
- L'inflammation provoque la destruction de la matrice extra-cellulaire, la diminution des facteurs de croissance
Risque d'infection et d'infections récidivantes
Comment faire le diagnostic du biofilm sur une plaie ?
Diagnostic clinique
Contexte
- En l'absence de critère diagnostique précis, on évoquera la présence de biofilm :
- - devant des plaies qui n'évoluent pas favorablement malgré des soins bien conduits et une prise en charge globale de l'étiologie et des facteurs de retard de cicatrisation
- - devant des épisodes infectieux récidivants
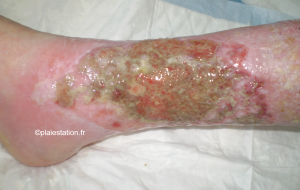
Aspect clinique du biofilm
- Le diagnostic clinique reste compliqué
- On évoque la notion de slime (photo). Le biofilm ressemble à un gel brillant qui recouvre la surface de la plaie. Néanmoins, il est parfois difficile de différencier slime et fibrine
- La couleur verte, bien connue et attribuée à la présence Pseudomonas aeruginosa, peut évoquer la présence d'un biofilm liée à cette bactérie
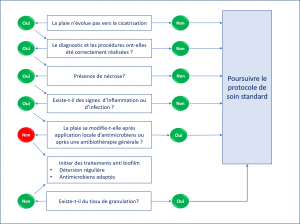
Algorithme diagnostic
- Un algorithme (schéma à droite) a été proposé selon une démarche clinique simple [6]
Diagnostic microbiologique
- Il n'y a a pas d'"examen de routine" capable de diagnostiquer un biofilm sur une plaie ni de marqueur biologique attestant leur présence.
- Les examens spécialisés (microscopie électronique , techniques moléculaires) peuvent parfois avoir des difficultés à différentier les bactéries planctoniques de celles incluses dans un biofilm
Prise en charge du biofilm sur une plaie chronique
- Un biofilm doit être pris en charge de façon rapide et "agressive" pour être efficace rapidement et limiter le risque de chronicité
- Quatre axes de prise en charge devant un biofilm
| Provoquer la dispersion du biofilm | Éviter la colonisation | Éviter la phase d'attachement irréversible | Éliminer les bactéries sessiles |
|---|
Hygiène de la plaie
- Une hygiène rigoureuse lors des soins reste un élément indispensable pour éviter la contamination des plaies. Pour autant les soins de plaies ne doivent pas être réalisés en "ambiance stérile"
- Le lavage à l'eau et au savon reste un élément indispensable, même s'il ne s'agit pas, à proprement parler, d'un acte de Détersion [7]
- On peut s'aider de solution de surfactant. Ces produits tensio-actifs réduisent la tension superficielle entre un liquide et un solide et aident à l'élimination des tissus dévitalisés, des corps étrangers et des bactéries planctoniques. Nous disposons, par exemple, du Prontonsan composé de PHMB (polyhexaméthylène biguanide) et de bétaïne
Détersion
- la Détersion de la plaie reste la pierre angulaire du traitement du biofilm
- Elle permet :
- - de détacher les bactéries sessiles de la surface d'adhérence
- - de provoquer la dispersion du biofilm
- - de supprimer les surfaces d'adhérence du biofilm : tissus dévitalisés (nécrose, fibrine, hématome) et corps étrangers (os, tendon, calcification, matériel prothétique, débris de pansements)
- Aucun moyen de Détersion ne peut être privilégié par rapport à un autre pour l'élimination du biofilm. Le mode de Détersion doit être évalué en fonction :
- - de l'étiologie et d'éventuelles contre-indications à une détersion mécanique
- - à la douleur induite
- - à la présence de corps étrangers qui peuvent justifier une détersion chirurgicale (os/ tendon / prothèse)
- - à l'état de la peau péri-lésionnelle: une détersion en milieu humide sera évitée en cas de macération de la peau périphérique
- - des disponibilités en matériel et des compétences du soignant
- - Cette technique de Détersion utilisant la curette peut être réalisée sous réserve de l'absence de contre-indication
- - On peut s'aider de solution de surfactant
- - Elle doit être envisagée rapidement devant des nécroses étendues, des plaies complexes avec exposition osseuse ou tendineuse
- Autres moyens de Détersion anti biofilm :
- - Irrigation sous pression
- - TPN (Thérapie à Pression Négative)
- - Ultra-sons
Agents anti-biofilm
- L'utilisation de ces produits s'impose après la phase de Détersion afin d'éviter la reformation du biofilm
- Les antiseptiques et antibiotiques locaux classiquement utilisés sont peu utiles et ne doivent pas être utilisés
- Les nouveaux agents anti-biofilm inter-agissent avec la matrice ou les composants du biofilm
- - Prontosan qui associe un antibactérien, le polyhexanide (1%), et un surfactant, la bétaïne (0.1%). Il est disponible sous forme de gel à utiliser directement sur les plaies ou de solution de lavage
- - Lavasept qui associe le polyhexanide et un surfactant, le macrogol
- - Octenilline qui associe un antisptique, l'octenidine chloride et un hydrogel
- - EDTA (acide ethylène diamine tetra-acétique) : ce produit assure le détachement des bactéries et augmente la perméabilité cellulaire. Il existe dans le pansement Aquacel Ag Extra®, en association avec de l'argent et du chlorure de benzethhium (BeCl)
- Pansement anti-biofilms
- - Pansements de la détersion en milieu humide en cas de nécrose et fibrine sèche : hydrogel / irrigo-absorbant
- - Pansements absorbants qui limitent les exsudats en cas de plaie exsudative
- - Pansements contenant un antiseptique : pansement à l'argent, pansements au PHMB
- - Pansement avec DACC (chlorure de dialkyl carbamoyle ): la gamme Sorbact® propose un pansement qui agit par un mécanisme d'hydrophobie en fixant les bactéries et le biofilm à sa surface
En pratique...
- Envisager la présence de biofilm sur toutes les plaies chroniques en retard de cicatrisation
- Assurer une Détersion quotidienne efficace, par une détersion mécanique ou par des techniques plus spécifiques et spécialisées si besoin (chirurgie , TPN, électrostimulation)
- Utiliser des pansements absorbants qui vont absorber les exsudats et piéger les bactéries
- Intérêt des pansements spécifiques comme Sorbact®
- L'utilisation des produits anti-biofilm est difficile en raison de l'absence de remboursement
Références
- ↑ www.wounds-uk.com/resources/details/position-document-management-biofilm
- ↑ James GA, Swogger E, Wolcott R, Pulcini Ed, Secor P, Sestrich J, Costerton JW, Stewart PS. Biofilms in chronic wounds. Wound Repair Regen. 2008;16:37-44.
- ↑ Wolcott RD, Rhoads DD, Bennett ME, Wolcott BM, Gogokhia L, Costerton JW, Dowd SE. Chronic wounds and the medical biofilm paradigm. J Wound Care. 2010;19(2):45-6, 48-50, 52-3.
- ↑ Metcalf DG, Bowler PG. Clinician perceptions of wound biofilm. Int Wound J. 2014;8. doi: 10.1111/iwj.12358.
- ↑ Malone M, Bjarnsholt T, McBain AJ et al. The prevalence of biofilms in chronic wounds: a systematic review and meta-analysis of published data. Journal of Wound Care 2017 26(1):20–5
- ↑ Percival SL, Vuotto C, Donelli G, Lipsky BA, Biofilms ans wounds : an identification algorithm and potential treatment options. Advances in Wound Care 2015 ;4(7):389-97
- ↑ Bellingeri A et al. Effect of a wound cleansing solution on wound bed preparation and inflammation in chronic Wounds: a single-blind RCT. J Wound Care 2016; 25: 3, 160–168.